Argomenti
L’idrogeno non è una fonte di energia, bensì un mezzo per accumularla, un portatore di energia che potrà cambiare in futuro molti settori della nostra vita e, con la cella a combustibile, potrebbe rivoluzionare l’intero sistema energetico, sia come combustibile nel traffico o, come fornitore di energia per produrre elettricità e calore. In tutti questi settori, l’idrogeno consente l’uso di fonti energetiche rinnovabili. Grazie all’idrogeno prodotto con il sole, in futuro sarà possibile cucinare o viaggiare con l’energia solare o eolica.
Caratteristiche fisiche e chimiche dell’Idrogeno
L’idrogeno (H) è un gas incolore, inodore e insapore, a molecola biatomica H2, inoltre è completamente atossico. Il suo peso specifico è 0,0899 g/l (è 14,4 volte più leggero dell’aria). L’idrogeno liquido ha un peso specifico di 70,99 g/l. Il punto di ebollizione è -252,77 °C.
Tra tutti i combustibili e carburanti, l’idrogeno possiede la maggiore densità energetica: 1 kg di idrogeno contiene la stessa energia di 2,1 kg di gas naturale o di 2,8 kg di benzina.
In rapporto al volume, la densità energetica di idrogeno liquido è circa ¼ di quella della benzina e circa 1/3 di quella del gas naturale. Il contenuto (in peso) di idrogeno nell’acqua Fiamma di idrogeno è di 11,2 %.
A temperatura ambiente l’idrogeno è chimicamente poco reattivo a causa dell’elevata stabilità delle molecole H2 che lo costituiscono. Acceso all’aria brucia con fiamma azzurrognola e fortemente calorifica, reagendo con ossigeno (O) per formare acqua:
2H2 + O2 → 2H2O
La reattività è molto maggiore quando si trova allo stato atomico; alcuni metalli (come per esempio il platino e il palladio) hanno la proprietà di assorbire idrogeno molecolare favorendone la dissociazione in idrogeno atomico e per questo vengono utilizzati come catalizzatori nelle reazioni in cui interviene idrogeno.
Effetti sull’ambiente dell’idrogeno
Dalla reazione di idrogeno con ossigeno risulta teoricamente solo acqua demineralizzata e anche la sua combustione in motori e in turbine a gas produce emissioni inquinanti in quantità minime e trascurabili. Con la temperatura di combustione aumentano le emissioni di NOx in modo esponenziale, ma queste possono essere controllate con un’adeguata regolazione della temperatura. Usando celle a combustibile che funzionano a bassa temperatura (per esempio PEM), l’emissione di sostanze inquinanti è praticamente zero, ma anche le emissioni da celle a combustibile ad elevata temperatura sono fino a 100 volte minori rispetto a quelle prodotte da impianti convenzionali. Nella valutazione dell’impatto ambientale si deve però sempre considerare l’intera catena cominciando dall’energia primaria fino all’uso finale.
Disponibilità e produzione di Idrogeno
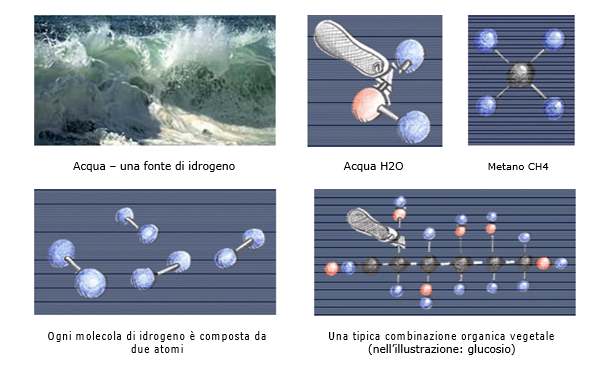
L’idrogeno è il più diffuso elemento nell’universo, ma sulla terra è combinato con altri elementi. L’idrogeno è presente nell’atmosfera solo in piccolissima concentrazione perché per la sua leggerezza tende a sfuggire al campo gravitazionale e a disperdersi nello spazio. È invece relativamente abbondante in forma combinata, soprattutto come acqua (H2O) e come composti organici (idrocarburi, biomasse, ecc.). Esempi sono il gas metano (CH4) composto da un atomo di carbonio (C) e quattro atomi di idrogeno e i vegetali formati da combinazioni organiche più complesse.
L’idrogeno si ricava da queste combinazioni mediante processi chimici che richiedono energia. Scientificamente si parla pertanto di una fonte energetica secondaria. Nel caso dell’idrogeno, l’energia per la sua preparazione non deve per forza derivare da fonti fossili, bensì anche dall’energia eolica, solare e idrica.
A livello mondiale, più di 500 miliardi di metri cubi di idrogeno vengono attualmente prodotti, immagazzinati, trasportati e utilizzati, prevalentemente nell’industria petrolchimica. La stragrande parte deriva da fonti fossili (gas naturale, petrolio) e risulta dall’elettrolisi cloro-sodio; circa 190 miliardi di metri cubi sono un prodotto secondario dei processi industriali di raffinazione del petrolio.
Elettrolisi cos’è e come funziona
Tra i vari metodi che consentono di ricavare idrogeno dall’acqua, l’elettrolisi è l’unico di rilevanza pratica, oggi e possibilmente anche domani. L’elettrolisi, nella sua forma convenzionale, è usata da oltre 80 anni per produrre idrogeno per il mercato.
La produzione di idrogeno per elettrolisi richiede l’impiego di energia elettrica e l’energia necessaria per scomporre l’acqua nei suoi due elementi H e O, è essenzialmente quella “immagazzinata” nell’idrogeno stesso.
La produzione di grandi quantità è pertanto economica solo in quei paesi dove l’elettricità può essere generata a costi convenienti, per esempio in Egitto, Islanda e Norvegia, dove la maggior parte dell’energia elettrica viene generata in centrali idroelettriche.
Quindi, per produrre idrogeno si deve investire energia elettrica. Per produrre energia utile da idrogeno, questo deve essere nuovamente legato ad un altro elemento, ed è questo che avviene in una cella a combustione.
Il principio
La decomposizione di acqua (H2O) in idrogeno e ossigeno per mezzo di elettrolisi viene realizzata in celle elettrolitiche (elettrolizzatori) che sono recipienti contenenti l’elettrolita e divisi in due compartimenti da un diaframma microporoso in grado di far passare ioni. Nel nostro caso l’elettrolita è l’acqua, ma in pratica si tratta di una soluzione acquosa di idrossido di sodio che ha migliori proprietà elettriche.
Nell’elettrolita sono immersi due elettrodi (conduttori metallici) collegati ai poli ad un generatore (una pila o un accumulatore; corrente elettrica continua). L’elettrodo, collegato al polo positivo, si chiama anodo, quello collegato al polo negativo catodo.
Sotto l’azione del campo elettrico generato dagli elettrodi, gli ioni presenti nell’elettrolita (acqua) migrano: quelli di carica positiva (cationi) verso il catodo, quelli di carica negativa (anioni) verso l’anodo. Giunti a contatto con il catodo, i cationi acquistano elettroni e formano specie neutre. Gli anioni, giunti a contatto con l’anodo, cedono elettroni (cioè si ossidano) formando analogamente specie neutre. L’idrogeno (H2) si accumula quindi dalla parte del catodo e l’ossigeno (O) da quella dell’anodo.
Usando come sorgente elettrica pannelli fotovoltaici o generatori eolici si pone il problema della discontinuità dell’alimentazione, ma i moderni elettrolizzatori hanno un comportamento dinamico e si adeguano al flusso discontinuo di energia elettrica, pertanto possono essere facilmente combinati con sistemi che usano fonti rinnovabili.
Elettrolisi ad alta pressione
Gli elettrolizzatori ad alta pressione si distinguono da quelli convenzionali per l’uso di materiali che consentono pressioni fino a 50 bar e oltre. Sono in fase di studio processi che dovrebbero consentire la combinazione dell’elettrolizzatore con generatori elettrici fluttuanti, per esempio con generatori eolici o impianti fotovoltaici.
Elettrolisi ad alta temperatura
Alcuni anni fa, l’elettrolisi ad alta temperatura è stata ritenuta un’alternativa interessante, perché ci si aspettava che potesse fornire una frazione dell’energia necessaria sotto forma di calore ad alta temperatura (800-1000 °C), ciò avrebbe consentito l’impiego di meno energia elettrica. Si è pensato all’utilizzo del calore prodotto da un concentratore solare (specchio parabolico) o di quello non utilizzato di una centrale termoelettrica. L’interesse per questa tecnologia è però sensibilmente diminuito.
Altri metodi di produzione di Idrogeno
Piccoli reformer
Per la produzione di idrogeno direttamente in combinazione con celle a combustibile sono allo studio piccoli reformer (reforming a vapore, ossidazione parziale). Questi sistemi sono destinati soprattutto ad applicazioni mobili in veicoli e in piccoli sistemi fissi. Con questo sistema si spera di poter sfruttare la maggiore densità energetica e il più semplice impiego dei convenzionali carburanti liquidi in celle a combustibili. Di particolare interesse sono il reforming e l’ossidazione parziale di metanolo e di benzina.
Reforming a vapore
Il reforming a vapore consiste nella trasformazione catalitica endotermica di idrocarburi leggeri (metano, benzina, ecc.) con l’uso di vapore acqueo. Su scala industriale, questi processi avvengono normalmente a temperature di 850 °C e pressioni di circa 2,5 bar e gli impianti di reforming a vapore producono circa 100.000 metri cubi di idrogeno all’ora.
Dal processo di trasformazione risultano idrogeno e biossido di carbonio, nonché metano e monossido di carbonio. Con l’impiego di vapore acqueo, nella cosiddetta reazione “shift”, la maggior parte del monossido di carbonio viene trasformata in biossido di carbonio ed idrogeno. Il biossido di carbonio e altre sostanze indeside-rate vengono successivamente rimossi dalla miscela di gas per assorbimento o con l’ausilio di membrane. Il gas residuo contiene materie combustibili (H2, CH4, CO) nella misura di circa il 60% e, insieme con una frazione del gas utile, viene usato per il riscaldamento del reformer.
Ossidazione parziale
Ossidazione parziale è detta la trasformazione termica di idrocarburi pesanti (per esempio residui di oli pesanti dell’industria petrolchimica) con l’ausilio di ossigeno e, parzialmente, anche di vapore acqueo. Con idonee quantità di ossigeno e di vapore acqueo, la gassificazione può avvenire senza energia fornita dall’esterno.
Il metodo dell’ossidazione parziale funziona anche con il carbone. In questo caso, il carbone finemente triturato viene miscelato con acqua per ottenere una sospen-sione con un contenuto solido del 50-70%. Il metodo conviene economicamente però solo in paesi come Sudafrica e Cina, grandi produttori di carbone.
Se, a medio e a lungo termine, l’idrogeno dovesse acquisire notevole importanza nel settore energetico, la sua produzione tramite reforming convenzionale, o ossidazione parziale di gas naturale, petrolio o carbone, è poco consigliabile dal punto di vista ambientale, perché non riduce le emissioni di CO2.
Metodi avanzati
Alcuni metodi moderni consentono la produzione di idrogeno anche senza emissioni di CO2, se l’energia elettrica necessaria viene prodotta da fonti rinnovabili. Fin dagli anni Ottanta, la KVAERNER ENGINEERING S.A. norvegese sta sviluppando il cosid-detto processo PLAM che, ad una temperatura di 1600 °C, consente la decomposi-zione di idrocarburi in carbonio puro e idrogeno. Il processo, che non causa gravi emissioni, richiede, oltre all’energia primaria (petrolio, gas naturale), solo energia elettrica e acqua per il raffreddamento. Fin dall’aprile 1992, un impianto pilota produce all’ora, con l’impiego di 1000 Nm3 gas naturale e 2100 kWe, circa 500 kg di carbonio (carbonio attivo) e 2000 Nm3 idrogeno. Un altro prodotto secondario è vapore ad alta temperatura con una potenza di circa 1000 kW. Considerando tutti i prodotti potenzialmente utilizzabili, l’impianto ha un rendimento di quasi il 100%. Il 48% dell’energia trasformata è contenuto nell’idrogeno, circa il 10% nel vapore e il 40% nel carbone attivo. Come prossimo passo è previsto un impianto industriale con una capacità di 100.000 Nm3/h di idrogeno.
Idrogeno da biomassa
Non esistono ancora metodi che consentono la produzione economica di idrogeno direttamente da biomassa. I vari metodi sui quali si concentra la ricerca si trovano in differenti stadi di sviluppo. Alcuni metodi prevedono l’uso di biomassa solida, per esempio sotto forma di pellets, mentre altri si basano sulla fermentazione di liquami e altre materie biologiche. I metodi più promettenti sono la gassificazione e la fermentazione di biomassa dai quali si ricava biogas.
Gassificazione di biomassa
Con la gassificazione a vapore acqueo si ottiene una miscela gassosa composta all’incirca da:
20 % di idrogeno
20 % di monossido di carbonio
10 % di biossido di carbonio circa 5 % di metano
45 % di azoto
Utilizzando ossigeno puro o solo vapore acqueo, la frazione di azoto non si forma.
Prima della gassificazione di biomassa, questa deve essere trasformata, in un processo termico, in coke, condensato e gas di vario tipo. Questo processo è detto scissione termica o pirolisi. La presenza di ossigeno nel reattore porta, invece che al reforming, all’ossidazione parziale dei prodotti intermedi. Nella seconda fase della reazione ”shift” il monossido di carbonio viene trasformato con acqua in idrogeno e biossido di carbonio. In seguito, in un impianto di assorbimento a pressione variabile, dalla miscela gassosa vengono separati l’idrogeno puro e i gas residui.
Fermentazione di biomassa
Da biomassa molto umida e da liquame, il biogas può essere prodotto tramite una fermentazione anaerobica. Nonostante che il biogas contenga elevate frazioni di monossido di carbonio e di metano e poco idrogeno, può essere utilizzato ugualmente in celle a combustibile ad alta temperatura (MCFC). In questo caso, agevolato dall’alta temperatura (circa 650 °C), il reforming del metano avviene direttamente a contatto con
l’elettrodo. Prima dell’uso in celle a combustibile PEM, il gas deve essere trasformato in idrogeno in un processo di reforming.
Idrogeno da etanolo
Alcuni scienziati statunitensi dell’Università del Minnesota hanno ultimamente presentato, nella rivista “Science” (febbraio 2004), un reattore portatile che trasforma alcol in idrogeno. L’apparecchio ecologico potrebbe rivoluzionare il trasporto di energia. Il reattore usa etanolo, un alcol ottenuto da biomassa (patate, grano e mais) e facilmente trasportabile. Nella trasformazione di etanolo in idrogeno si forma anche biossido di carbonio, ma la quantità di CO2 è la stessa che le piante hanno assorbito dall’atmosfera durante la loro crescita.
Come spiega il suo inventore Gregg Deluga, il nuovo reattore è piccolo, portatile e contiene già l’energia necessaria. In una prima fase, una parte dell’etanolo viene bruciata per ottenere la temperatura necessaria alla reazione. Abbinato ad una cella a combustibile, l’apparecchio sviluppa una potenza di un chilowatt.
La struttura dell’apparecchio è semplice: tramite una valvola viene iniettata una miscela di acqua ed etanolo nella camera preriscaldata dove il liquido evapora e si mescola con l’aria. Un catalizzatore di rodio e di cerio trasforma poi la miscela in idrogeno e biossido di carbonio. Secondo i ricercatori, oltre il 95 % dell’etanolo viene trasformato in idrogeno. La durata del contatto con il catalizzatore ammonta solo ad un centesimo di secondo e questo consente la produzione di grandi quantità di idrogeno. Nella reazione si forma però anche monossido di carbonio non sopportato dalle celle a combustibile previste per applicazioni mobili, per esempio in automobili.
Idrogeno direttamente da biomassa
Produrre idrogeno direttamente da biomassa e senza il processo di elettrolisi ha un grande fascino, perché consentirebbe l’uso di una fonte energetica rigenerabile, l’ottenimento di un alto rendimento e un bilancio energetico molto equilibrato.
Ci sono vari processi biologici in cui l’idrogeno viene liberato o risulta come prodotto intermedio. I due principali processi sono: la fotosintesi, che richiede luce, e la fermentazione che avviene anche al buio. Nel secondo processo sono alghe e microrganismi a produrre idrogeno. Ambedue questi metodi sono ancora in fase sperimentale, ma rappresentano delle opzioni per il futuro dell’economia energetica basata sull’idrogeno.
Immagazzinamento dell’Idrogeno
Vi sono tre principali metodi per immagazzinare l’idrogeno:
- allo stato gassoso sotto pressione
- allo stato liquido
- per assorbimento
Tutti e tre i metodi hanno dei vantaggi e degli svantaggi che li qualificano per i differenti impieghi.
Immagazzinamento di idrogeno gassoso sotto pressione
Di immagazzinamento sotto pressione si parla quando un gas viene tenuto sotto una pressione maggiore di quella normale. Per ogni livello di pressione viene usato un certo tipo di serbatoio. I serbatoi per pressioni minori hanno una dimensione maggiore, ma una resistenza minore alla pressione e quindi costano meno rispetto a quelli destinati a pressioni maggiori.
I grandi serbatoi sono normalmente impiegati in applicazioni fisse dove c’è abbastanza spazio. In applicazioni mobili, dove lo spazio è molto limitato, si usano invece serbatoi compatti e resistenti ad alte pressioni che possono anche arrivare a 700 bar.
Le vecchie bombole di acciaio avevano un peso elevato, quelle moderne, costruite con materiali compositi (fibre di carbonio con rivestimento interno di alluminio), sono invece più leggere.
L’immagazzinamento di grandi quantità di idrogeno per usi industriali, avviene anche in serbatoi sotterranei (caverne), nei quali il gas può essere stoccato in condizioni fino a 50 bar. Questo sistema è già utilizzato negli Stati Uniti e in Francia.
Immagazzinamento di idrogeno liquido
Allo stato liquido, l’idrogeno ha una maggiore densità, ma questo stato lo acquista solo ad una temperatura di –253 °C. I serbatoi destinati allo stoccaggio di idrogeno liquido a bassissima temperatura sono detti “criotecnici” e rendono minime le perdite dovute al riscaldamento. L’immagazzinamento di idrogeno liquido si presta soprattutto in applicazioni mobili (veicoli) dove lo spazio è molto limitato. Il rifornimento dei veicoli richiede impianti automatizzati, in parte già esistenti. Questo tipo di immagazzinamento conviene solo in quei casi in cui l’uso richiede idrogeno liquido, perché la liquefazione del gas e la conservazione del liquido sono operazioni costose.
Immagazzinamento per assorbimento
Oltre all’immagazzinamento di idrogeno sotto pressione e in forma liquida, esiste anche quello per assorbimento.
Con questo metodo si sfrutta la proprietà che certe leghe metalliche hanno di assorbire l’idrogeno. Un metallo che assorbe idrogeno si raffredda e, per recuperare l’idrogeno, si deve riscaldarlo. In rapporto al volume, la capacità di questi accumulatori è molto vantaggiosa, ma purtroppo questi serbatoi sono molto pesanti e costosi e pertanto e non adatti ad applicazioni mobili. I loro vantaggi sono la semplicità e la sicurezza; anche quando il serbatoio dovesse subire un guasto, l’idrogeno con si disperde. Essi lavorano a
pressione quasi normale, non causano perdite dovute all’evaporazione e hanno un effetto purificante sull’idrogeno. Un’applicazione commerciale di questa tecnologia è quella nei sottomarini.
Carbon Nanotubes
I nano tubi si ottengono dal carbonio e potrebbero in futuro rivoluzionare la tecnologia dell’immagazzinamento di idrogeno. La scoperta, che grandi quantità di idrogeno possono essere immagazzinate in piccolissime strutture tubolari di grafite, risale solo a pochi anni fa. Da allora, molti gruppi di ricercatori stanno lavorando allo sviluppo e al perfezionamento di questa tecnologia, ma i risultati non sono ancora definitivi. Si è però potuto dimostrare che il principio è valido e la tecnologia promettente. I futuri sviluppi sono attesi con molto interesse.
Trasporto dell’idrogeno
Le tecniche di trasporto di idrogeno si fondano principalmente sulle tecniche di immagazzinamento precedentemente descritte.
L’idrogeno gassoso sotto pressione viene oggi normalmente trasportato in speciali serbatoi su camion o per ferrovia, direttamente dal produttore al consumatore. È stata proposta anche la costruzione di idrogenodotti simili ai metanodotti tramite i quali, in futuro, l’idrogeno potrebbe essere fornito a ogni casa. Idrogenodotti esistono già in alcune regioni della Germania e, in tutto il mondo, sono in uso oltre 1000 km di questi pipeline.
L’idrogeno liquido può essere trasportato in speciali autocisterne o in speciali contenitori caricabili su camion; negli Stati Uniti esiste persino una pipeline per il trasporto, lunga 40 km. Si pensa oggi anche al trasporto di idrogeno liquido per mare in navi simili di quelli con le quali oggi viene trasportato il gas naturale, ma sono state progettate anche delle navi speciali.
Per le quantità di idrogeno che oggi vengono trasportate via mare, si è però rivelato più adatto ed economico l’uso di contenitori speciali. Questi contenitori per idrogeno liquido hanno dimensioni standard e possono essere trasportati in tutto il mondo via mare, per ferrovia e su camion e il trasbordo può avvenire in ogni terminal.
Sicurezza utilizzo Idrogeno
L’idrogeno è molto reattivo e reagisce facilmente con ossigeno formando acqua. Non comporta un maggiore rischio rispetto al petrolio, al gas naturale o all’uranio. Le sue caratteristiche fisiche e chimiche non rappresentano particolari pericoli. Per questo motivo non esistono particolari norme di sicurezza se non quelle che valgono per tutti i gas infiammabili.
Nel caso di incidenti, i combustibili liquidi comportano spesso la rapida espansione dell’incendio sul luogo dell’incidente, che può causare, specialmente nel caso di incidenti con camion e aeroplani, la morte di molte persone. L’idrogeno evapora in questi casi rapidamente verso alto, ma quando l’idrogeno si libera in ambienti confinati, come per esempio in autorimesse o tunnel, esiste un maggiore pericolo di esplosione. In questi luoghi si deve provvedere ad una maggiore ventilazione e ad altri dispositivi di sicurezza.
L’industria usa l’idrogeno da più di 100 anni e i dispositivi di sicurezza sviluppati nel frattempo sono considerati sufficienti.
L’incendio che, nel 1937, distrusse il dirigibile LZ 129 “Hindenburg” a Lakehurst, non è stato causato dall’idrogeno con il quale era riempito l’involucro, bensì dalle caratteristiche chimiche ed elettrostatiche della pittura esterna che prese fuoco quando il dirigibile si trovò nel campo elettrico di un temporale. La massa di idrogeno si incendiò solo successivamente.
In realtà, l’idrogeno è bruciato con la fiamma verso l’alto, e coloro che tra i passeggeri non si lanciarono dalla cabina, sopravvissero all’incidente. Se si fosse incendiato un carburante liquido, l’incidente sarebbe stato molto più grave, perché si sarebbe formato un tappeto di fuoco sotto la navicella del dirigibile.
L’idrogeno nel serbatoio di un’automobile non comporta un maggiore pericolo rispetto alla benzina. Questo è stato dimostrato da ricercatori (Michael Swain) dell’Università di Miami in uno spettacolare test. I tecnici hanno appiccato il fuoco a due automobili, una ad idrogeno, l’altra a benzina. Come era prevedibile, ambedue le macchine hanno preso fuoco, ma, mentre quella a benzina è stata completamente avvolta dalle fiamme dopo 60 secondi, quella ad idrogeno è rimasta quasi illesa. Solo un’enorme vampata è guizzata in alto, ma si è spenta quasi subito.
Questa ottima guida è la copia del PDF , pubblicato anni fa su questo sito (vecchia gestione) e realizzato da Assa-cee.org







davvero interessante, ma cercavo anche riguardo le recento applicazioni sulle automobili, di generatori di idrogeno alimentati dalla corrente continua della batteria; sembra che non si verifichi il concetto energia elettrica=idrogeno prodotto ; 1=1 no
Il rapporto è molto basso con l’idrogeno se calcoli l’energia consumata, mi sembra uno 0,40%